Phénomènes et corrosion électrolytiquesCet exposé est conçu avec la haute et très estimée participation de Karel Skala, ingénieur de l'Ecole Polytechnique Fédérale de Lausanne en Suisse. |
|
Ayant une rubrique sur l'aluminium, Je ne pouvais passer sous silence ce phénomène méconnu et très controversé. Bête noire des possesseurs de bateaux en métal, et plus particulièrement en aluminium, la corrosion électrolytique a déjà fait couler beaucoup d'encre et quelques bateaux. Pour bien en comprendre le processus, il est important de revenir deux siècles en arrière. Vers l'année 1800, monsieur Volta inventa la pile électrique. Le principe de cette pile reste le même aujourd'hui, et la corrosion électrolytique des métaux découle directement de ce principe. Ce qui suit est une vulgarisation volontaire du phénomène. |
|
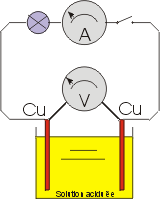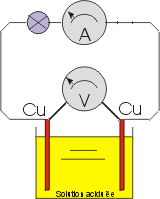
Principe de la pile électrique de monsieur Volta sous une forme pratique |
|
Prenons un réservoir en verre contenant une solution d'eau et d'acide sulfurique et plongeons une lame de zinc pur et une lame de cuivre; branchons ensuite entre ces deux lames un voltmètre, nous observons une polarisation des deux lames et donc une tension, environ 1 volt. La lame de cuivre étant positive par rapport à celle de zinc. La plaque de cuivre est donc le pôle positif (+) et la plaque de zinc le pôle négatif (-) de la pile que nous venons de créer. |
|